วัตถุดำ (Blackbody) ไม่ได้หมายถึงวัตถุสีดำ แต่เป็นวัตถุในอุดมคติ (Ideal) ซึ่งมีคุณสมบัติในการดูดกลืนรังสีทุกชนิด มันจึงไม่สามารถสะท้อนแสงได้ อย่างไรก็ตามวัตถุดำจะแผ่รังสีออกจากตัวของมันเอง เมื่อรังสีถูกหักเหด้วยแท่งแก้วปริซึมหรือแผ่นเกรตติ้ง ก็จะให้แถบสเปกตรัมยาวต่อเนื่อง วัตถุที่มีคุณสมบัติที่ใกล้เคียงกับวัตถุดำมากที่สุดก็คือ ดาวฤกษ์ เช่น ดวงอาทิตย์ เป็นต้น
ปี ค.ศ.1814 โจเซฟ ฟอน ฟรังโฮเฟอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองซ้ำกับเซอร์ไอแซค นิวตัน แต่ใช้แผ่นเกรตติ้งแทนแท่งแก้วปริซึมหักเหแสงอาทิตย์ เขาพบเส้นมืดปรากฏบนแถบสเปกตรัมมากกว่า 600 เส้น ดังภาพที่ 1 (ในปัจจุบันตรวจพบมากกว่า 30,000 เส้น) นักเคมีในยุคต่อมาเรียกเส้นมืดเหล่านี้ว่า เส้นดูดกลืน (Absorption lines) ธาตุแต่ละชนิดทำให้เกิดเส้นดูดกลืนที่แตกต่างกัน
ภาพที่ 1 เส้นสเปกตรัมของดวงอาทิตย์
ปี ค.ศ.1859 โรเบิร์ต บุนเซน และ กุสตาฟ เคิร์ชฮอฟ นักเคมีชาวเยอรมัน ได้ทำการทดลองเผาก๊าซร้อน แล้วพบว่า แสงจากก๊าซร้อนทำให้เกิด เส้นสว่างบนแถบสเปกตรัม ก๊าซแต่ละชนิดให้จำนวนและตำแหน่งของเส้นสว่างแตกต่างกัน เราเรียกเส้นสว่างนี้ว่า “เส้นแผ่รังสี” (Emission lines) ในเวลาต่อมา เคิร์ชฮอฟ ได้ค้นพบความสัมพันธ์ระหว่าง เส้นดูดกลืนและเส้นแผ่รังสี
ตามกฏเคอร์เคิร์ชฮอฟ (Kirchhoff’s laws) ดังนี้
กฏข้อที่ 1 วัตถุดำทำให้เกิดแถบสเปกตรัมต่อเนื่อง (Continuous spectrum) ไม่ปรากฏเส้นมืด
กฏข้อที่ 2 กลุ่มก๊าซร้อนโปร่งใส ทำให้เกิดเส้นแผ่รังสี (Emission lines) เป็นเส้นสีสว่างบนแถบสเปกตรัมมืด
กฏข้อที่ 3 กลุ่มก๊าซเย็นโปร่งใส ขวางกั้นการแผ่รังสีจากวัตถุดำ ทำให้เกิดเส้นดูดกลืน (Absorption lines) ปรากฏเป็นเส้นสีดำบนแถบสเปกตรัมต่อเนื่อง ดังภาพที่ 2
ภาพที่ 2 กฏสามข้อของเคิร์ชฮอฟ
เส้นสเปกตรัมที่แผ่ออกจากวัตถุแต่ละชนิด มีลักษณะเฉพาะตัวเช่นเดียวกับเส้นลายมือของมนุษย์ ถ้าเราทราบข้อมูลสเปกตรัม เราก็จะสามารถวิเคราะห์ได้ว่า องค์ประกอบของวัตถุต้นกำเนิดมีองค์ประกอบเป็นอะไร วัตถุที่มีคุณสมบัติใกล้เคียงกับวัตถุดำ เช่น ดวงอาทิตย์ และไส้หลอดไฟต่างๆ จะให้สเปกตรัมต่อเนื่อง มีเส้นดูดกลืนสีดำคาดในแนวดิ่ง เนื่องจากมีบรรยากาศห่อหุ้มอยู่ ส่วนก๊าซเรืองแสงเช่น นีออน ให้สเปกตรัมเป็นแถบมืด และมีเส้นแผ่รังสี สว่างคาดในแนวดิ่ง ดังภาพที่ 3
ภาพที่ 3 สเปกตรัมของวัตถุต่างๆ
ในการศึกษาองค์ประกอบของดาวฤกษ์ด้วยการวิเคราะห์สเปกตรัม นักดาราศาสตร์แบ่งดาวฤกษ์ออกเป็น 7 ประเภท ตามอุณหภูมิ ได้แก่ ดาวประเภท O, B, A, F, G, K, M โดยมีคำพูดให้ท่องจำได้ง่ายว่า Oh Be A Fine Girl Kiss Me ดาว O มีอุณหภูมิสูงถึง 35,000 K ส่วนดาว M มีอุณหภูมิต่ำเพียง 3,500 K (ภาพที่ 4) เราจะเห็นได้ว่า สเปกตรัมของดาวฤกษ์แต่ละประเภทจะมีเส้นดูดกลืนสีดำ ซึ่งแสดงถึงองค์ประกอบในบรรยากาศที่ห่อหุ้มดาวต่างๆ กัน เส้นดูดกลืนของสเปกตรัม O เกิดจากการดูดกลืนของอะตอมไฮโดรเจนและฮีเลียม ส่วนเส้นดูดกลืนของดาว K เกิดจากการดูดกลืนของธาตุหนักหลายชนิด นอกจากนั้นยังพบเส้นดูดกลืนของโมเลกุลอยู่เป็นจำนวนมาก เนื่องจากอุณหภูมิต่ำพอที่อะตอมสามารถจับตัวกันเป็นโมเลกุล เช่น ไททาเนียมออกไซด์ (TiO) เป็นต้น
อย่างไรก็ตามดาว O บางดวงอาจมีธาตุหนักปนอยู่ เนื่องจากเกิดจากการรวมตัวของกลุ่มฝุ่นที่เป็นซาก ซูเปอร์โนวา ซึ่งเกิดจากการระเบิดของดาวฤกษ์รุ่นก่อนๆ
ภาพที่ 4 สเปกตรัมของดาวประเภทต่างๆ
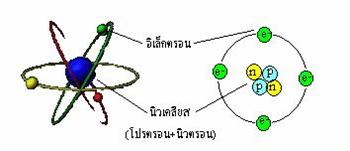
ค.ศ.1910 เออร์เนส รูเธอร์ฟอร์ด นักเคมีฟิสิกส์ชาวนิวซีแลนด์ นำเสนอแบบจำลองโครงสร้างอะตอมว่า นิวเคลียสของอะตอมประกอบด้วย ประจุบวก (โปรตอน) อยู่ตรงกลาง มีประจุลบ (อิเล็กตรอน) โคจรล้อมรอบเป็นชั้นๆ โดยที่มวลส่วนใหญ่ไม่น้อยกว่า 99.98% อยู่ที่นิวเคลียสของอะตอม ปัจจุบันเป็นที่ทราบกันดีว่า นิวเคลียสของอะตอมประกอบด้วยโปรตอนและนิวตอน
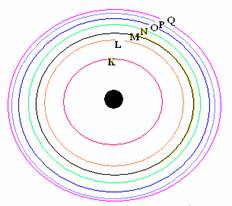
ค.ศ.1911 นีล บอฮ์ร นักฟิสิกส์ชาวดัทช์ ได้สร้างแบบจำลองอะตอมของไฮโดรเจน เพื่ออธิบายความสัมพันธ์ระหว่างโครงสร้างอะตอมและสเปกตรัมของอะตอม อะตอมของไฮโดรเจนมีโปรตอน 1 อนุภาคอยู่ตรงใจกลาง มีอิเล็กตรอน 1 อนุภาค โคจรล้อมรอบ วงโคจรของอิเล็กตรอนมี 4 ชั้น คือ n = 1, 2, 3 และ 4 ตามลำดับ ดังในภาพที่ 5 โดยทั้งนี้ อิเล็กตรอนสามารถกระโดดข้ามชั้นวงโคจรจากวงหนึ่งไปสู่อีกวงหนึ่งได้ เมื่อมันได้รับหรือสูญเสียพลังงาน
ภาพที่ 5 แบบจำลองอะตอมของไฮโดรเจน
เมื่ออะตอมได้รับพลังงานจากภายนอก อิเล็กตรอนจะกระโดดขึ้นสู่วงโคจรชั้นนอก ทำให้เกิดเส้นดูดกลืนในแถบสเปกตรัม ตามกฎข้อที่ 3 ของเคิร์ชฮอฟ แต่เมื่ออะตอมสูญเสียพลังงาน อิเล็กตรอนจะลดลงสู่วงโคจรชั้นใน ทำให้เกิดเส้นแผ่รังสีสว่างบนแถบมืด ตามกฎข้อที่ 2 ของเคิร์ชฮอฟ
ภาพที่ 6 ซ้ายมือ แสดงเส้นดูดกลืนของไฮโดรเจน-อัลฟา (H-Alpha) ซึ่งเกิดจากอะตอมได้รับรับพลังงานในช่วงความยาวคลื่น 656.3 นาโนเมตร ทำให้อิเล็กตรอนของไฮโดรเจนในวงโคจร n = 2 ยกตัวขึ้นสู่วงโคจร n = 3 ภาพที่ 6ขวามือ แสดงเส้นแผ่รังสีของไฮโดรเจน-อัลฟา ซึ่งเกิดจากการสูญเสียพลังงานของอะตอม ทำให้อิเล็กตรอนของไฮโดรเจนลดตัวจากวงโคจร n = 3 ลงไปสู่วงโคจร n = 2 ปลดปล่อยพลังงานในช่วงความยาวคลื่น 656.3 นาโนเมตร
ภาพที่ 6 กลไกการดูดกลืนและแผ่รังสี
นีล บอฮ์ร อธิบายถึงความสัมพันธ์ระหว่างความยาวคลื่นกับโครงสร้างอะตอมไฮโดรเจน ด้วยสูตร
1/

= R {(1/N
2) – (1/n
2)}
โดย N = ลำดับวงโคจรชั้นใน
n = ลำดับวงโคจรชั้นนอก
R = Rydberg constant = 1.097 x 10
7 m
-1 
= ความยาวคลื่น (หน่วยเป็นเมตร) ที่ดูดกลืน หรือแผ่รังสี
เขาใช้สูตรนี้ อธิบายเส้นดูดกลืนต่างๆ บนสเปคตรัมของดวงอาทิตย์ ซึ่งเกิดจากการเปลี่ยนแปลงชั้นวงโคจรของ อิเล็กตรอนของไฮโดรเจน ดังภาพที่ 7
การเลื่อนชั้นวงโคจของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 1 กับชั้น n = 2, 3, 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 122 nm, 103 nm, 97 nm, 95 nm, 94 nm ตามลำดับ (nm คือ นาโนเมตร หรือ 10-9 เมตร) เรียกว่า ไลมานซีรีส์ อยู่ในช่วงคลื่นอัลตราไวโอเล็ต จึงมีพลังงานสูงมาก
การเลื่อนชั้นวงโคจรของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 2 กับชั้น n = 3, 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 656 nm (H-alpha), 486nm (H-beta), 434nm (H-gamma), 410nm (H-delta) ตามลำดับ เรียกว่า บาลเมอร์ซีรีส์ ซึ่งเป็นแสงในช่วงคลื่นตามองเห็น นักดาราศาสตร์นิยมศึกษาพวยก๊าซบนดวงอาทิตย์ (Prominences) ด้วยแสงไฮโดรเจน-อัลฟา ที่ความยาวคลื่น 656 nm
การเลื่อนชั้นวงโคจรของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 3 กับชั้น n = 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 1875nm, 1282nm, 1094nm ตามลำดับ เรียกว่า ปาสเชนซีรีส์ ในช่วงอินฟราเรด
ภาพที่ 7 การดูดกลืน / แผ่รังสีซีรี่ย์ต่างๆ
เราสามารถคำนวณระดับพลังงานภายในอะตอมได้โดยใช้สูตร
E = hc/

= h

โดยที่

คือความถี่ของแสง, h = 4.14 x 10
-15 อิเล็กตรอนโวลท์ วินาที (eV s)
ทั้งนี้ 1 eV มีค่าเท่ากับ 1.6 x 10
-19 จูล (J)
ภาพที่ 9 แสดงให้เห็นกลไกของระดับพลังงานภายในอะตอม เรียกว่า กลไกควอนตัม (Quantum machanics) อิเล็กตรอนมีพลังงานต่ำสุดเมื่ออยู่ในวงโคจรชั้นล่างสุด n = 1 ซึ่งเรียกว่า “Ground state” วงโคจรชั้นสูงกว่าเราเรียกว่า “Excited state” อิเล็กตรอนจะกระโดดขึ้นสู่วงโคจรชั้น n = 2 ได้ต่อเมื่อได้รับพลังงานจากโฟตอน Lymann-alpha ซึ่งมีความยาวคลื่น 122 nm ซึ่งมีพลังงาน 10.19 eV ในทำนองกลับกันเมื่ออิเล็กตรอนลดวงโคจรจากชั้น n = 2 ลงสู่ Ground state ก็จะแผ่รังสี Lymann-alpha ซึ่งมีความยาวคลื่น 122 nm ในทำนองเดียวกันเมื่ออิเล็กตรอนยกตัวจาก ground state ไปยังวงโคจรชั้น n = 3 ต้องใช้พลังงาน 12.07 eV ซึ่งได้มากจากโฟตอน Lymann-beta ซึ่งมีความยาวคลื่น 103 nm และเมื่ออิเล็กตรอนลดวงโคจรจากชั้น n = 3 ลงสู่ Ground State มันจะแผ่รังสี Lymann-beta ซึ่งมีความยาวคลื่น 103 nm
อย่างไรก็ตามหากอะตอมได้รับพลังงานจากโฟตอนของรังสีอัลตราไวโอเล็ต หรือคลื่นที่สั้นกว่า ซึ่งมีพลังงานสูงมากกว่า 13.6 eV อิเล็กตรอนจะหลุดออกจากอะตอมไปสู่สภาวะ Ionizationation หรือหลุดเป็นประจุ
ุ